Альбумин в корме для собак
Ветер Д.С. – руководитель терапевтического отделения ИВЦ МВА, ветеринарный врач, специалист визуальной диагностики.
Бобровский М.А. – ветеринарный врач-терапевт ИВЦ МВА соискатель кафедры ветеринарной хирургии.
Масимов Эдуард Нусратович – ветеринарный врач ИВЦ МВА , дерматолог, эндокринолог, терапевт, кандидат биологических наук.
Энтеропатии с потерей белка (PLE) – это синдром, характеризующийся хронической потерей белка в просвет желудочно-кишечного тракта животных. PLE достаточно редко встречается у человека, однако это довольно распространенное осложнение, встречающееся у собак и намного реже у кошек. Наиболее подверженными к данному синдрому породами собак являются: йоркширские терьеры, ротвейлеры, немецкие овчарки, норвежские лундехаунды, золотистые ретриверы, басенджи, боксеры, ирландские сеттеры, пудели, мальтезы и шарпеи.

Авторы статьи не выявили достоверной корреляции PLE с определенным полом и возрастом животных. Однако в одном исследовании сообщалось, что в 61% случаев PLE у йоркширских терьеров, это были самки; средний возраст животных составлял 7.7 ± 3.0 лет.
Как правило, данный синдром может развиться на фоне первичных воспалительных заболеваний кишечника (лифоцитарно-плазмоцитарного, эозинофильного энтерита и д.р.), лимфангиэктазии, лимфомы кишечника, грибкового поражения (гистоплазмоза), острого бактериального или вирусного энтеритов, аутоиммунных заболеваний кишечника и некоторых других патологических процессах. При этом клиническая картина может выглядеть несколько вариабельно, в зависимости от этиологии заболевания. Среди общих клинических признаков, отражающих наличие PLE, можно выделить следующее:
- Хроническую, реже острую, диарею.
- Разной степени выраженности кахексию.
- Хроническую рвоту. (Рвота – достаточно частый симптом. Однако она может отсутствовать у некоторого процента пациентов или присутствовать на сравнительно поздних этапах заболевания).
- Ухудшение или полное отсутствие аппетита.
- Периферические отеки конечностей.
- Наличие асцита, в более редких случаях гидроторакса.
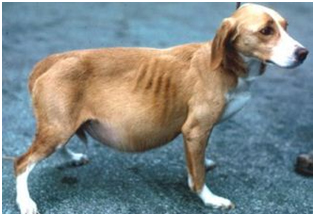 Последние два симптома, обусловлены снижением онкотического давления крови, вследствие гипоальбуминемии (15-25 г/л). Животные с хронической диареей и рвотой, при несвоевременном обращении владельцев, могут поступать с симптомами анемии (от умеренной до ярко выраженной), дегидратации, гиповолемии/гиповолемического шока. Одышка и признаки дыхательной недостаточности могут наблюдаться у пациентов со скоплением значительного количества жидкости в грудной полости. Пальпация может выявить от умеренной до выраженной болезненность брюшной стенки, признаки флуктуации, объемные образования. В ходе проведения аускультации, возможно выявление признаков гидроторакса в виде приглушения звуков сокращения сердца. Следует отметить, что не у всех собак с PLE, присутствует выраженные клинические признаки; единственными симптомами могут быть снижение веса и гипоальбуминемия.
Последние два симптома, обусловлены снижением онкотического давления крови, вследствие гипоальбуминемии (15-25 г/л). Животные с хронической диареей и рвотой, при несвоевременном обращении владельцев, могут поступать с симптомами анемии (от умеренной до ярко выраженной), дегидратации, гиповолемии/гиповолемического шока. Одышка и признаки дыхательной недостаточности могут наблюдаться у пациентов со скоплением значительного количества жидкости в грудной полости. Пальпация может выявить от умеренной до выраженной болезненность брюшной стенки, признаки флуктуации, объемные образования. В ходе проведения аускультации, возможно выявление признаков гидроторакса в виде приглушения звуков сокращения сердца. Следует отметить, что не у всех собак с PLE, присутствует выраженные клинические признаки; единственными симптомами могут быть снижение веса и гипоальбуминемия.
Во всех случаях гипоальбуминемии, с характерными для PLE клиническими признаками, проводимая диагностика должна быть достаточно агрессивной т.к. этиология синдрома разнообразна, а детальная проработка и исключение каждого заболевания по отдельности, а также оценка результативности эмпирически-назначенной терапии может занять достаточно много времени. Первой диагностической задачей, является установление причины потери белка. Исследование кожи необходимо для исключения поражений, способных привести к потере белка. Как правило, поражения кожи способные вызвать гипоальбуминемию, достаточно очевидны при первичном осмотре (например ожоги большой площади). Быстрый осмотр позволяет выяснить, действительно ли кожа является причиной гипоальбуминемии.
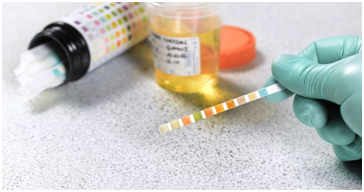 Следующим этапом диагностики является исключение нарушения синтеза альбумина печенью и потеря белка с мочой, вследствие нефропатий. Необходимо получить образцы мочи для проведения общего клинического анализа и оценки соотношения белок-креатинин, с целью установления факта протеинурии. В случае наличия серьезной нефропатии, у собак может наблюдаться разной степени выраженности азотемия. Исследование функции печени, должно включать определение уровня желчных кислот.
Следующим этапом диагностики является исключение нарушения синтеза альбумина печенью и потеря белка с мочой, вследствие нефропатий. Необходимо получить образцы мочи для проведения общего клинического анализа и оценки соотношения белок-креатинин, с целью установления факта протеинурии. В случае наличия серьезной нефропатии, у собак может наблюдаться разной степени выраженности азотемия. Исследование функции печени, должно включать определение уровня желчных кислот.
Концентрация аминотрансфераз зачастую возрастает при разрушении гепатоцитов, однако интерпретация значений активности АЛТ, АСТ, ГГТ и ЩФ, должны проводиться с осторожностью, так как у некоторых собак с тяжелыми, хроническими заболеваниями печени, не отмечается высокого уровня гепатоцеллюлярных ферментов. Уровень глобулинов может сохранятся на нормальном уровне или быть незначительно повышен например в случае гистоплазмоза. Абсолютная гипопротеинэмия встречается реже, в основном на поздних стадиях заболевания.
Гиперхолестеринемия в сочетании с гипоальбуминемией, более характерна для PLE (вторично к хронической мальабсорбции) или печеночной недостаточности. В тоже время гиперхолестеринемия в в сочетании с гипоальбуминемией, наводит на мысли о потери белка вследствие нефропатии. Снижение уровня сывороточного кальция (общего и ионизированного) имеет многофакторную этиологию, ассоциированную со снижением альбумина как основного транспортного белка, снижением усвоения витамина D и нарушением усвоения магния. В клиническом анализе крови может наблюдаться лимфопения, особенно в случаях лимфангиэктазии; достаточно часто можно встретить признаки регенераторной, анемии, вследствие снижения усвоения железа и цианокобаламина.
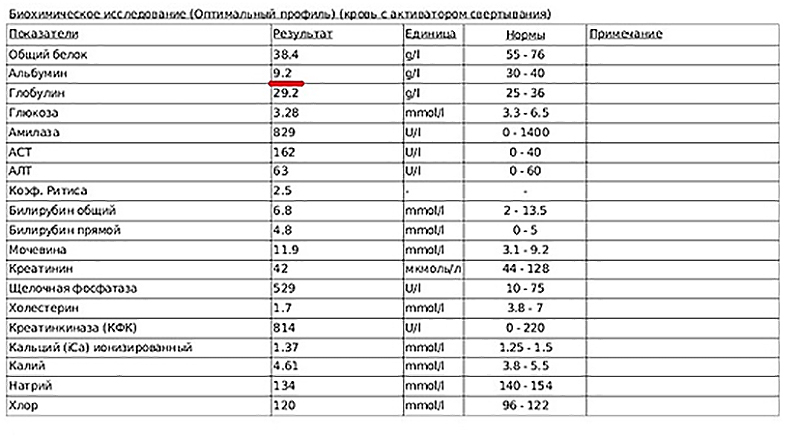
Рис 1. Биохимический анализ крови
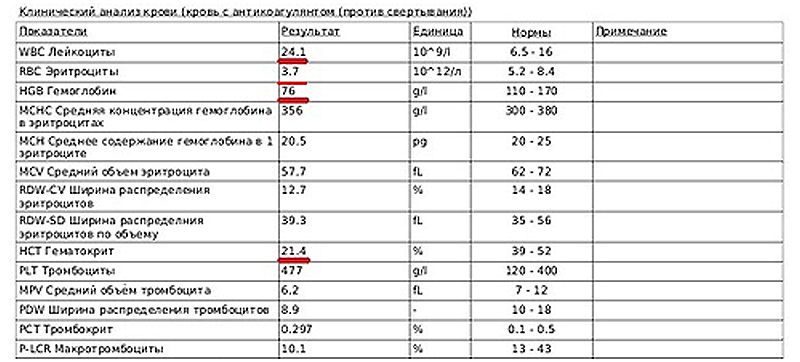
Рис 2. Клинический анализ крови
После исключения нарушений функций печени или заболеваний почек, при концентрации альбумина 15-25≤ г/л, PLE является разумным первичным диагнозом. Измерение ингибитора α1-антитрипсина (α1-протеазы) в образцах кала, может использоваться для дальнейшего подтверждения PLE. α1-антитрипсин имеет молекулярный вес, сходный с альбумином. Этот белок находиться в сосудистом и интерстициальном пространстве, в лимфе. В отличие от альбумина и других белков плазмы, α1-антитрипсин способен противостоять разложению кишечными и бактериальными протеазами. При PLE, могут наблюдаться потери α1-антитрипсина в просвет кишечника и выведение его с калом, что может быть определено методом иммуноферментного анализа. Данный тест достаточно трудоемок в плане соблюдения точной методологии забора, хранения и транспортировки образцов. Определение α1-антитрипсина в кале, является полезным исследованием как для непосредственной диагностики PLE, так и для уточнения диагноза в случае сочетанного течения PLE с печеночной недостаточностью или нефропатией. Однако интерпретация результатов данного исследования может вызвать определенные сложности. В целом этот тест редко используется в клинической практике. На территории РФ, данное исследование не проводится.
“Золотым стандартом” PLE, является определение количества меченого изотопом хром-51 альбумина в кале, после его внутривенного введения. Практическое применений данного теста, также ограничено.
Последующая диагностика должна быть направлена на выявление этиологии текущей энтеропатии. Проведение рентгенологических исследований, в том числе рентгеноконтрастных исследований ЖКТ, как правило являются мало информативными. Ультразвуковая диагностика является полезным исследованием для обнаружения специфических изменения кишечной стенки. Например утолщение стенки кишечника и наличие гиперэхогенных полос в подслизистом слое может свидетельствовать о наличии лимфангиэктазии. Еще более выражено эти признаки наблюдаются в случае приема жирной пищи накануне исследования, что приводит к большему расширению лимфатических сосудов стенки кишечника. Ультразвуковая диагностика может выявить очаговые изменения, не доступные для эндоскопической визуализации.
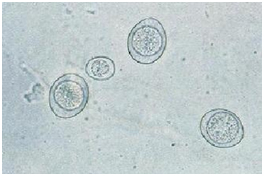
 Исследование кала может выявить наличие яиц паразитов или простейших. Судановое окрашивание кала используется для определения стеатореи, что указывает на плохое усвоение жиров. Цитологическое исследование мазков фекалий может выявить гифы грибов.
Исследование кала может выявить наличие яиц паразитов или простейших. Судановое окрашивание кала используется для определения стеатореи, что указывает на плохое усвоение жиров. Цитологическое исследование мазков фекалий может выявить гифы грибов.
Окончательный диагноз устанавливается после забора биоптатов для проведения гистологического исследования. Биопсия может быть выполнена посредством ЭГДС, лапаротомии или эндоскопически-ассистированной лапаротомии. Выбор того или иного метода забора биопсии зависит от многих факторов,таких как наличие эндоскопических навыков, наличие данных о вероятной локализации патологического очага, наличия необходимого эндоскопического оборудования и д.р.. Из преимуществ проведения лапаротомии, можно выделить возможность полнослойного забора биоптата а также возможность забора материала из нескольких сегментов кишечника, недоступных в случае применения гибкой эндоскопии. Однако понятие “полнослойный материал” не является синонимом “диагностически значимый”. Большое внимание должно быть уделено наложению серозно-мышечных швов, которые в случае PLE, могут представлять угрозу из-за длительной регенерации, и угрозы несостоятельности шва.
 Во многих случаях очаги поражения невозможно увидеть со стороны серозной оболочки а т.к. некоторые причины PLE могут быть локально расположены в разных отделах кишечника, важно иметь возможность визуализировать их со стороны слизистой оболочки. В случае же забора материала во время проведения гибкой эндоскопии, возможно выявить характерные изменения слизистой оболочки кишечника и провести точечный забор материала. Забор материала нужно осуществлять из нескольких отделов кишечника, стараясь взять не менее 5-6 образцов из двенадцатиперстной и подвздошной кишки (по данным Willard, M., статистически, данный отдел кишечника наиболее часто вовлекается в патологический процесс приводящий к развитию PLE). Несмотря на то, что окончательный диагноз будет поставлен на основании патоморфологии, в некоторых случаях можно поставить предварительный диагноз (как в случае лимфангиэктазии) опираясь на характерные изменения слизистой оболочки, обнаруживаемые при эндоскопическом исследовании (многочисленные, диффузные, расширенные лимфатические сосуды, могут быть визуализированы как большие белые везикулы на слизистой оболочке). Признаки дилатации лимфатических сосудов, лучше визуализируются при скармливании жирной пищи перед проведением исследования.
Во многих случаях очаги поражения невозможно увидеть со стороны серозной оболочки а т.к. некоторые причины PLE могут быть локально расположены в разных отделах кишечника, важно иметь возможность визуализировать их со стороны слизистой оболочки. В случае же забора материала во время проведения гибкой эндоскопии, возможно выявить характерные изменения слизистой оболочки кишечника и провести точечный забор материала. Забор материала нужно осуществлять из нескольких отделов кишечника, стараясь взять не менее 5-6 образцов из двенадцатиперстной и подвздошной кишки (по данным Willard, M., статистически, данный отдел кишечника наиболее часто вовлекается в патологический процесс приводящий к развитию PLE). Несмотря на то, что окончательный диагноз будет поставлен на основании патоморфологии, в некоторых случаях можно поставить предварительный диагноз (как в случае лимфангиэктазии) опираясь на характерные изменения слизистой оболочки, обнаруживаемые при эндоскопическом исследовании (многочисленные, диффузные, расширенные лимфатические сосуды, могут быть визуализированы как большие белые везикулы на слизистой оболочке). Признаки дилатации лимфатических сосудов, лучше визуализируются при скармливании жирной пищи перед проведением исследования.
Стратегия лечения PLE основывается на выборе адекватной нутрицептивной терапии и контроле уровня воспаления. В случае постановки диагноза на ранних стадиях диагностики, при выявлении очевидных патогенетических факторов (наличие в образцах кала простейших, яиц гельминтов или выявление возбудителей парво/ коронавирусного энтеритов в ректальных смывах), необходимо сосредоточить внимание на лечении выявленной патологий согласно действующим рекомендациям.
Животные поступившие с нестабильными показателями гемодинамики, в состоянии шока, нуждаются в проведении интенсивной терапии. Классический подход к проведению интенсивной терапии животным с гиповолемическим шоком (особенно в случае наличия выпота в анатомические полости или периферическими отеками мягких тканей, свидетельствующих о возможном низком онкотическом давлении), будет отличаться тем, что быстрое введение больших объемов кристаллоидов до введения коллоидов может быть необоснованным из-за низкого онкотического давления и неспособности вследствие этого удержать вводимый объем жидкости.
Болюсное введение кристаллоидов, в начале терапии, должно быть скорректировано в сторону уменьшения объемов и увеличения времени введения или должно проводиться максимально аккуратно при наличии лабораторно подтвержденных сведений о концентрации альбумина. Коллоидным раствором выбора, может являться волювен в дозировке 3мл/кг или альбумин 0.5-1г/кг в/в. В последующей терапии, также может потребоваться дополнительное введение альбумина, для поддержания онкотического давления крови. Многие пациенты поступают в состоянии от умеренной до выраженной дегидратации вследствие острой/хронической диареи и/или рвоты, и поэтому им, параллельно со стабилизацией гемодинамики, должна быть проведена адекватная инфузионная терапиия, направленная на регидратацию.
 Проведение торакоцентеза, и удаление жидкости из грудной полости целесообразно в тех случаях, когда скопление ее значительных объемов, могут приводить к развитию дыхательной недостаточности. Назначение фуросемида в таких случаях нецелесообразно и может привести к усугублению дегидратации и снижению ОЦК. В некоторых случаях сильной анемии (RBC 2-3 х 1012/л<; HCT 20%<; HGB 100 g/l<), может потребоваться проведение гемотрансфузии.
Проведение торакоцентеза, и удаление жидкости из грудной полости целесообразно в тех случаях, когда скопление ее значительных объемов, могут приводить к развитию дыхательной недостаточности. Назначение фуросемида в таких случаях нецелесообразно и может привести к усугублению дегидратации и снижению ОЦК. В некоторых случаях сильной анемии (RBC 2-3 х 1012/л<; HCT 20%<; HGB 100 g/l<), может потребоваться проведение гемотрансфузии.
Во всех случаях неустановленной или не до диагностированной PLE, целесообразным считается назначение эмпирической терапии. В значительном количестве случаев, такая терапия может привести к нивелированию острых симптомов заболевания и стабилизировать общее состояние животного. Однако, важно не останавливаться в поисках этиологических факторов, удовлетворившись положительной динамикой лечения. В случае некоторых энтеропатий, особенно ВЗК, целесообразным является назначение антибактериальных препаратов (например сочетание метронидазола 15мг/кг каждые 12ч и амоксициллина 7,0 мг/кг с клавулановой кислотой 1,75мг/кг, п/к каждые 24ч; энрофлоксацина 5мг/кг, п/к, в/м каждые 12ч). В случае ВЗК, целесообразно назначение стероидных противовоспалительных препаратов – преднизолон 1-2мг/кг каждые 12-24 часа. Однако решение о назначение иммуносупрессивной терапии, должно приниматься с осторожностью. Купирование рвоты можно осуществлять введением маропитанта – 1мг/кг, п/к. Животным с PLE, необходимо дополнительное введение цианокобаламина, из-за нарушения его синтеза и усвоения вследствие мальабсорбции. Дополнительное введение цианокобаламина, будет способствовать коррекции легкой и умеренной анемии. Рекомендуемая суточная доза цианокобаламина – 250-500 мкг, в/м каждые 24 часа.
Нутрицептивная терапия заключается в назначении легкоусвояемых кормов с низким содержанием жира для предотвращения дальнейшей лимфангиэктазии. Рекомендовано назначение высококалорийных кормов с большим количеством легкоусвояемых белков и низким содержанием сырой клетчатки. У собак с IBD, многими специалистами отмечена положительная динамика при назначении кормов, содержащих гидролизованные белки. В случае отсутствия аппетита более 72 часов, необходимо произвести установку назоэзофагогастрального зонда или сформировать эзофагостому, для обеспечения энтерального питания. Назначение правильного, диетического питания является очень важным в терапии PLE! В некоторых случаях легкой и умеренной PLE, нутрицептивная терапия позволила стабилизировать состояние пациентов, без назначения фармакотерапии.
Список используемой литературы:
- “Canine Protein Losing Enteropathies” – Willard, M.; Texas A&M University, Department of Small Animal Clinical Sciences, College of Veterinary Medicine, Texas, USA.
- “Diagnosis and Management of Chronic Enteropathies in Dogs” – Kenneth W. Simpson BVM&S, PhD, DipACVIM, DipECVIM-CA; College of Veterinary Medicine, Cornell University, Ithaca, NY.
- “Protein losing enteropathy in dogs – the beginning of end?” – Frédéric Gaschen, Dr.med.vet., Dr.habil., DACVIM and DECVIM-CA; Dept. of Veterinary Clinical Sciences, Louisiana State University School of Veterinary Medicine.
- “Diagnosis and management of protein-losing enteropathy” – Stanley L. Marks, BVSc, PhD, DACVIM (Internal Medicine, Oncology), DACVN Professor of Small Animal Medicine, Associate Director of the Small Animal Clinic University of California, Davis, School of Veterinary Medicine, Davis, CA, USA/
- “Protein losing enteropathy in Yorkshire Terriers – Retrospective study in 31 dogs” – D. BOTA1, A. LECOINDRE2, A. POUJADE3, M. CHEVALIER4, P. LECOINDRE2, F. BAPTISTA5, E. GOMES1, J. HERNANDEZ1*; 1 Centre Hospitalier Vétérinaire Fregis, 43 av. Aristide Briand, 94110 Arcueil, France; 2 Clinique des Cerisioz, Route de Saint-Symphorien-d’Ozon 69800 Saint-Priest France; 3 Laboratoire d‘Anatomie Pathologique Vétérinaire du Sud-Ouest, 129, route de Blagnac 31201 Toulouse cedex 2, France; 4 Laboratoire Biomnis, 17/19 avenue Tony Garnier, 69007 Lyon, France; 5 StemCell2Max Biocant Park Nucleo 04, Lote 02 3060-197 Cantanhede Portugal.
- “Medical and nutritional management of protein-losing enteropathy” – Jane Armstrong, DVM, MS, MBA, DACVIM; University of Minnesota St. Paul, MN
Вернуться к списку
Источник
Клиника экспериментальной терапии НИИ КО РОНЦ имени Н.Н. Блохина РАМН,
Ветеринарная клиника «Биоконтроль».
«Институт развития ветеринарной интенсивной терапии, анестезиологии и реаниматологии — ВИТАР»
Корнюшенков Е.А.
Актуальность проблемы адекватного кровозамещения и проведения рациональной инфузионной терапии не вызывает сомнений особенно при выполнении высокоинвазивных хирургических манипуляций. Рациональная инфузионная терапия одно из главных составляющих успешного лечения большинства хирургических пациентов. Исключения составляют лишь «малые» не осложненные операции типа кастрации и грыжесечения. Роль инфузионной терапии, ее масштаб и сложность зависят от целого ряда обстоятельств: объема и сложности вмешательства, общего состояния пациента, уровня и обширности поражения органов, специфики заболевания (воспалительный процесс, злокачественная опухоль) [1,9].
Трудности с получением препаратов крови, аллергическая реакция, нехватка доноров, инфицирования и другие организационные моменты усиливают сложность этой проблемы [4].
В связи с этим у клиницистов проявляется значительный интерес к использованию коллоидных плазмозаменителей. Коллоидные растворы представляют собой водные растворы крупных молекул, вес которых превышает 10000 дальтон (Да). Эти молекулы плохо проникают через эндотелий капилляров, поэтому коллоидные растворы повышают онкотическое давление плазмы [2]. Весь объем введенного коллоидного раствора остается в плазме, что приводит к большему увеличению объема циркулирующей крови (ОЦК), чем при использовании кристаллоидов.
Эффект увеличения ОЦК временный, его выраженность и продолжительность зависят от типа коллоидного раствора [7].
Выбор кровезаменителя определяется особенностями патологии, состоянием водно- электролитного гомеостаза, знанием врача функциональных особенностей плазмозаменителя, а также его доступностью.
Существует такое понятие как «идеальный плазмозаменитель». Он должен отвечать определенным требованиям:
- Высокий волемический эффект (не менее 1.0).
- Достаточно длительный период полувыведения.
- Благоприятное влияние на гемореологию.
- Отсутствие депрессивного влияния на иммунную систему.
- Отсутствие анафилаксических реакций.
- Отсутствие влияния на синтез сывороточного альбумина печенью.
Также существенное значение имеет простота хранения и транспортировки, а также его фармако-экономические показатели.
Плазмозаменители подразделяются на два основных класса:
- Плазма донорской крови и препараты крови (растворы сывороточного альбумина).
- Растворы синтетических коллоидов.
Плазма донорской крови.
Волемический эффект донорской плазмы крови (менее 1,0) оставляет за собой роль исключительного гемостатика для случаев значимой патологии гемостаза. Поэтому основными показаниями к применению плазмы являются: гипопротеинемия, гипоальбуминемия и недостаток факторов свертываемости.
Альбумины.
Использования человеческого сывороточного альбумина (ЧСА), в настоящие время пересматривается относительно применения его в интенсивной терапии. Исходя из особенностей биологических эффектов (опасность «утечки» из кровеносного русла через поврежденный эндотелий сосуда и др.), клиницисты все чаще рассматривают ЧСА как не эффективный плазмозаменитель в медицине критических состояний [4, 5, 8].
На основании рандомизированных данных в гуманной медицине делается вывод о том, что не следует использовать растворы ЧСА в лечение пациентов с гиповолемией, ожогами и значительной гипопротеинемией, поскольку такая тактика не только не уменьшает летальность, но и напротив ее существенно увеличивает [4].
Более того, рассматриваются некоторые предостережения относительно его широкого применения, если концентрация в плазме не достигает критического уровня. Поэтому предлагают использовать ЧСА только в частных клинических случаях: как лекарственное средство – транспорт медикаментов, как специфический антиоксидант (для связывания избытка образовавшегося оксида азота), как средство подавление избытка продукции ренина при гепаторенальном синдроме. Согласно шокирующим данным Cohrane [5], смертность в группе пациентов отделения реанимации, получивших растворы альбумина, оказались достоверно выше, чем в контрольной.
В клинической практике применяют 4.5 % раствор ( изоонкотический ) и 20 % ( гиперонкотический) раствор человеческого альбумина.
Концентрированный 20 % раствор альбумина вызывает перемещение жидкости из интерстициального пространства в сосудистое русло.
Синтетические коллоиды.
Растворы синтетических коллоидов подразделяются на три класса:
- Плазмозаменители на основе желантина.
- Плазмозаменители на основе декстрана.
- Плазмозаменители на основе гидроксиэтилкрахмала.
Плазмозаменители на основе желатина, вырабатываются из желатина костного мозга крупного рогатого скота. В процессе приготовления его постепенно нагревают и окисляют перекесью водорода [6].
Типичным представителем на отечественном рынке являются препараты Гелофузин B. Braun, желатиноль. Желатиноль, имеет широкий диапозон молекулярно-массового распределения – от 5 до 100 кД. Минусами при работе с данными препаратами является:
- Низкий волемический эффект (около 0.5).
- Короткий период полувыведения (1-2 часа).
- Опасность «утечки» активного вещества в интерстициальное пространство.
- Нередкие анафилактоидные реакции.
- Рецидив исходных гемореологических расстройств (агрегация тромбоцитов, секвестрация эритроцитов).
- Избыток кальция в желатиноле, что исключает применение данного препарата с цитратными трансфузионными средами и некоторыми лекарственными препаратами.
Следует отметить, что препараты желатиноля в США считаются настолько опасными, что исключены к применению [5].
Плазмозаменители на основе декстрана.
Декстран представляет собой полисахарид, состоящий из линейных остатков глюкозы. На данный момент эта группа препаратов относятся к одним из самых популярных плазмозаменителей в нашей стране используемых как в медицине, так и в ветеринарии.
Достоинства плазмозаменителий на основе декстрана:
- Высокая водоудерживающая способность и высокий волемический эффект (превышает 1.0).
- Благоприятно влияет на гемореологию, характерная особенность для низкомолекулярных декстранов.
- Антитромботическое действие.
- Благоприятный фармакоэкономический показатель.
Кроме того, декстраны обладают специфическим защитным свойством в отношении ишемических и реперфузиознных повреждений, риск которых всегда увеличивается при обширных хирургических вмешательствах. В последние годы при производстве активного вещества декстранов улучшилась очистка этих препаратов от анафилактоидных компонентов, что существенно снижает количество аллергических реакций при использовании их в практике. Однако остаются и некоторые неблагоприятные эффекты этих плазмозаменителей:
- Торможение синтеза альбумина печенью.
- Декстран выделяется только почками, поэтому не могут применяться при острой почечной недостаточности. Некоторые специалисты полагают, что декстраны опасны способностью вызывать «ожоги» эпителия почечных канальцев и поэтому противопоказаны при ишемии и почечной недостаточности.
- Аллергическая реакция.
- При многократном применение, на протяжении значительного периода времени, развитие так называемого приобретенного тезариусмоса с блокадой клеток Купфера и появление системных реакций на транслокацию кишечной микрофлоры.
- На фоне дегидратации и олигоурии возможность развития ятрогенных патологий – осмотического нефроза – «декстрановая почка».
- Опасность существенных расстройств гемостаза при использовании значительных доз на фоне нестабильного гемостаза: декстрановая коагулопатия не имеет антидотов.
Все эти обстоятельства и прогресс науки привели к появлению нового класса препаратов плазмозаменителей на основе гидроксиэтилированного крахмала (ГЭК).
Гидроксиэтиловый крахмал – это исходное название полимерной молекулы, полученной из восковидного маиса или сорго и состоящей главным образом из амилопектина (98%). Амилопектин – это полисахарид со сложной разветвленной структурой, сильно напоминающий гликоген.
Отличительной способностью данных плазмозаменителей на основе ГЭК является:
- Молекулярная масса
- Молекулярное замещение
- DS – степень замещения: число гидроксильных групп на глюкозную единицу ГЭК – это основной показатель, отражающий время циркуляции активного компонента в сосудистом русле.
Растворы гидроксиэтилкрахмала отличаются большим диапазоном молекулярного веса. Чем выше концентрация, молекулярный вес и степень замещения, тем больше и продолжительней увеличивается ОЦК. С другой стороны, чем больше степень замещения, тем выраженнее побочные эффекты [2,3].
Характеристика наиболее распространенных гидроксиэтилкрахмалов приведена в таблице 1.
| ГЭК | Молекулярная масса( Тыс. Да) | Степень замещения | Концентрация |
| Hespan | 450 | 0.7 | 6% |
| Инфукол | 200 | 0.5 | 6%, 10% |
| Рефортан | 200 | 0.5 | 6%, 10% |
| HAES – стерил | 200 | 0.5 | 6%, 10% |
| Гемохес | 200 | 0.5 | 6%, 10% |
| Волювен | 130 | 0.4 | 6% |
| Венофундин | 130 | 0.4 | 6% |
Достоинства ГЭК:
- Высокий непосредственно волемический эффект
- Нет «утечки» активного вещества в интерстиции жизненно важных органов, например легкие.
- Длительное время циркуляции.
- ГЭК выделяется преимущественно через почки, но может частично метаболизироватся.
- В отличии от ЧСА, ГЭК блокирует синтез эндотелинов на фоне системной воспалительной реакции.
- Раствор ГЭК умеренно тормозит синтез альбуминов.
- Анафилактические реакции не описаны.
Кроме восстановления объема гидроксиэтеловый крахмал делает обратимыми изменения проницаемости капилляров, вызванные свободными радикалами кислорода при повреждении вследствие реперфузии [3]. Кроме того, он улучшает микроциркуляцию, хотя пока не известно является ли это следствием улучшением капиллярной перфузии [5].
В таблице 2 представлены дозы введения всех видов плазмозаменителей.
| Плазмозаменитель | Плазма | Альбумины | Желантины | Декстраны | ГЭК |
| Кошки | 10 мл/кг | 10 – 20 мл/кг | 5 – 20 мл/кг | 5 мл/кг | 5 – 10 мл/кг |
| Собаки | 250 мл на 10, 20 кг | 10 – 20 мл/кг | 5 – 20 мл/кг | 20 мл/кг | 10 – 40 мл/кг |
В дозах до 100 мл/кг ГЭК, не является токсичным для собак и не вызывает у них аллергию (Ballinger et al., 1996) [6].
Материалы и методы.
За период с 5.06.2005 по 10.05.2006 в Клинике экспериментальной терапии НИИ КО РОНЦ им. Н.Н. Блохина РАМН было прооперировано 156 животных в возрасте от 3 до 20 лет с кровопотерей от 15 до 70% ОЦК. Из них 62 животных (39.8%) по поводу рака молочной железы, 6 (3.8%) торакотомий, 35 (22.4%) лапаротомий (из них 10(6.5%) лобэктомий, 3 (1.9%) нефроэктомии, 14 (8.9%) спленэктомий, 8 (5.1%) операций по поводу рака предстательной железы), 16 (10.3%) ампутаций, 16 (10.3%) ламинэктомий, 21 (13.4%) операция по поводу опухолей голова и шеи. Величину кровопотери оценивали общепринятым гравиметрическим способом по кровяным салфеткам и отсосу. Во время операции осуществляли мониторинг частоты сердечных сокращений (ЧСС), артериального давления (систолического, диастолического и среднего) и сатурацию кислорода не инвазивным методом с помощью пульсоксиметра. Восполнение физиологических потребностей во время операций обеспечивали раствором Рингера – лактат и другими изотоническими солевыми растворами. Также всем животным проводилась терапия гидроксиэтилкрахмалами ( Рефортан 6%). При кровопотери более 15% ОЦК, дозы ГЭК составляли 8-12 мл/кг, при кровопотери более 30% ОЦК 12- 20мл/кг, при кровопотери более 50% 20-40 мл/кг.
Результаты.
При оценке данных мониторинга состояния гемодинамики (ЧСС, АД) насыщения гемоглобина кислородом оставалось в пределах нормы или было чуть ниже нормы даже при такой патологии как разрыв селезенки. У трех животных с острым кровотечением в послеоперационный период мы наблюдали нарушения со стороны гемостаза. 2 животных погибло через несколько часов после операции, с признаками развития синдрома дессеменированого внутрисосудистого свертывания.
Выводы.
Среди плазмозаменителей предпочтительны производные гидроксиэтилкрахмала и декстрана. Альбумины несут в себе больше побочных свойств и поэтому ведутся исследования по уточнению реальной клинической эффективности альбумина и его побочных свойств. Вполне вероятно, что скоро он будет полностью вытеснен более эффективными, безопасными и дешевыми препаратами ГЭК. Среди препаратов ГЭК предпочтительны низкомолекулярные, однако эти препараты еще не совсем доступны для свободного пользования.
Summary
Plasma substitutes in intensive care of small animals.
(Author: Kornushenkov E.A.; Clinic of experimental therapy GURONC named after N.N. Blohin RAMN)
Derivatives of hydroxyethylamylum and dextran are most preferable among plasma substitutes. Albumins bear more side effects therefore researches are performed to define the real clinical efficiency of albumin and its side effects.
It is most probably that soon albumin will be fully replaced by more effective, safe and cheap medications of hydroxyethylamylum.
Литература
1. Е.С. Горобец. // Современные тенденции в периоперационной инфузионной терапии. Анестезиология и реаниматология №3, 2002.
2. Гилберт Парк, Пол Роу.// Инфузионная терапия. Издательство Бином, Москва 2005.
3. Е.В. Елагин, В.А. Михельсон, А.Л. Галустьян, О.В. Михеев, Е.А. Казиахмедов, О.А. Гольдина, Ю.В. Горбачевский. // Влияние нового современного лекарственного средства инфукол ГЭК, на основе гидорксиэтилированного крахмала 200/0,5 второго покаления на систему гемостаза при ортопедических операциях у детей. – Вестник интенсивной терапии, Москва 2004.
4. А. П. Зилбер. // Кровопотеря и гемотрансфузия. Издательство Петрозаводского университета. Петрозаводск. 1999.
5. А.Л. Костюченко. // Волемически активные плазмозаменители в интенсивной терапии – материалы Ассоциации Анестезиологов и Реаниматологов Северо – Запада. Санкт – Петербург 2004.
6. Р. Кирк, Д. Бонагура. // Современный курс ветеринарной медицины Кирка. Аквариум, 2005.
7. Мокеев И.Н. // Инфузионно – трансфузионная терапия. Москва 2002.
8. Н.А. Степанова, А.У. Лекманов, В.А Красовский, Я.В. Олейников, Е.В. Михайлов, Ю.В. Горбачевский, О.А. Гольдина, Т.Е. Табакина. // Инфузионно — трансфузионная терапия острой кровопотери во время ранних операций у детей с тяжелой термической травмой. – Анестезиология и реаниматология № 2, 2004.
9. А. Шандер. // Бескровные методы лечения. Альтернативы переливанию крови. Материалы международных симпозиумов проблемы бескровной хирургии. Москва 2001.
Источник